Tolerase® G, una endopeptidasa específica de prolina o Propil-oligopeptidasa, que ayuda a la digestión del gluten de forma efectiva y segura. Esta enzima es extraída de una cepa de Aspergillus Niger y se conoce por el nombre de AN-PEP (Aspergillus niger-prolyl endopeptidase)1.
Tolerase® G se activa en el estómago en condiciones de pH bajo (entre 3,5 y 5,5) y es resistente a la digestión por parte de enzimas pepsinas. Esto hace que sea ideal para ejercer su función en el estómago, convirtiéndola en una potencial enzima digestiva1.
Ventajas 1,6-8
La Tolerase G Propil-oligopeptidasa, es una enzima excepcionalmente eficaz para la digestión del gluten en el estómago. Está científicamente probada para digerir diferentes epítopos de gluten ricos en prolina. Es una enzima estable y está activa en condiciones estomacales a un pH bajo, también es resistente a la pepsina. Por otro lado, presenta una seguridad confirmada en estudios de toxicidad de regulación y demostrada en ensayos clínicos. Esta enzima tiene forma microgranulada con excelentes propiedades de manejo y está fabricada en Europa.
Eficacia 1,7,8
Tras siete años de investigación y trabajo, se ha demostrado que Tolerase G digiere el gluten de forma eficaz. Esta enzima degrada, específicamente, las regiones inmunogénicas dentro de las proteínas del gluten. Las células T del sistema inmunológico del cuerpo, sensibles al gluten, dejan de reaccionar al mismo después de la degradación con Tolerase G y se mantienen estables y activas en condiciones gástricas. Otras enzimas que afirman digerir el gluten y que se utilizan actualmente en los suplementos dietéticos son mucho menos activas.
Seguridad 1
Tolerase G es segura para toda la población, ya que se ha comprobado con estudios de toxicidad y ensayos clínicos.
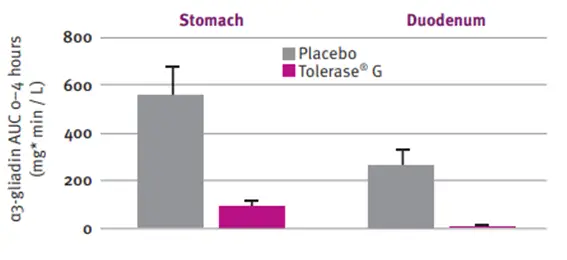
Eficacia para degradar el gluten en el estómago y el duodeno 1
Se evalúo la actividad que ejerce la enzima Tolerase® G sobre el epítopo Glia-α3 en comparación con un placebo y se observó que lo degradaba significativamente en el estómago y duodeno de voluntarios sanos.

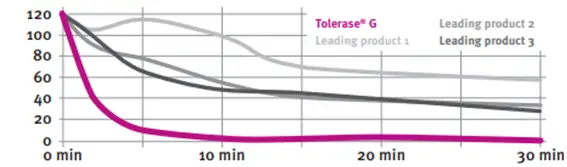
Comparación con otras enzimas comercializadas 1
Se ha comprobado que las enzimas digestivas del gluten, que se comercializan, no son tan efectivas como Tolerase G. Para ello se realizó un estudio in vitro con diferentes productos y se midió la actividad digestiva de cada uno de ellos. Tolerase G fue la enzima que mejor resultados dio.

Referencias
- Tolerase G. (S. f.). DSM. Recuperado a 8 de marzo de 2023 https://www.dsm.com/content/dam/dsm/foodandbeverages/en_US/documents/hnh/tolerase_g_leaflet.pdf
- Hausch, F., Shan, L., Santiago, N. A., Gray, G. M. y Khosla, C. (2002). Intestinal digestive resistance of immunodominant gliadin peptides. American journal of physiology, 283(4), pp. G996-G1003. DOI: 10.1152/ajpgi.00136.2002.
- Bold, J. y Rostami, K. (2011). Gluten tolerance; potential challenges in treatment strategies. Gastroenterology and hepatology from bed to bench, 4(2), pp. 53-57. Recuperado a 8 de marzo de 2023 https://pubmed.ncbi.nlm.nih.gov/24834157/
- Hopman, E. G. D., le Cessie, S., von Blomberg, B. M. E. y Mearin, M. L. (2006). Nutritional management of the gluten-free diet in young people with celiac disease in The Netherlands. Journal of Pediatric Gastroenterology and Nutrition, 43(1), pp. 102-108. DOI: 10.1097/01.mpg.0000228102.89454.eb
- Stepniak, D. et al. (2006). Highly efficient gluten degradation with a newly identified prolyl endoprotease: implications for celiac disease. American journal of physiology, 291(4), pp. G621-629. DOI: 10.1152/ajpgi.00034.2006
- Mitea, C. et al. (2008). Efficient degradation of gluten by a prolyl endoprotease in a gastrointestinal model: implications for coeliac disease. Gut, 57(1), pp. 25-32. DOI: 10.1136/gut.2006.111609