El zinc es uno de los elementos más abundantes dentro de las células, siendo necesario para una amplia gama de procesos fisiológicos.
- Es un componente integral de las proteínas involucradas en las estructuras celulares y la estabilización de las membranas celulares.
- Funciona para mantener la integridad estructural de hasta 3000 factores de transcripción en el genoma humano y es esencial para la actividad biológica de más de 300 metaloenzimas dependientes de zinc1.
- Además de sus numerosas funciones estructurales y catalíticas, el zinc está involucrado en la regulación de una amplia variedad de genes, impactando procesos tan diversos como las interacciones proteína-proteína, el metabolismo de los ácidos nucleicos, la replicación celular, apoptosis, transducción de señales y el mantenimiento de la función inmunitaria, por lo que su influencia llega a todos los órganos y tejidos2-5.
La homeostasis del zinc es crucial para una función adecuada del sistema inmune. Tanto la deficiencia de zinc como su exceso provocan alteraciones graves en el número y actividad de células inmunes, lo que puede aumentar la susceptibilidad a las infecciones y el desarrollo de enfermedades especialmente las inflamatorias6-9 .
A pesar de esta extrema importancia fisiológica la deficiencia de zinc es sorprendentemente común, afectando hasta una cuarta parte de la población en los países en desarrollo, pero también al mundo desarrollado como resultado del estilo de vida, la edad y de factores mediados por enfermedad 10,11. Como consecuencia el estado del zinc es un factor crítico que puede influir en la inmunidad (también la antiviral), particularmente porque las poblaciones con deficiencia de zinc a menudo tienen mayor riesgo de contraer infecciones (de todo tipo pero también virales como el VIH o la hepatitis C)12 .
Zinc en la respuesta inmune innata y adaptativa: Desregulación inmune dependiente de zinc


La deficiencia de Zinc deteriora la inmunidad, retrasa la cicatrización de heridas, causa inflamación de bajo grado independiente de la producción de citoquinas inflamatorias y aumenta el estrés oxidativo13 .
Estos desequilibrios en la homeostasis incluyen tanto la deficiencia de zinc como la sobrecarga de este elemento, causando ambas disfunciones inmunes graves. La intoxicación por zinc es, sin embargo, rara y sus síntomas se deben principalmente a la deficiencia de cobre.
La deficiencia provoca atrofia tímica y linfopenia, especialmente con disminución del número de células T auxiliares (Th) CD4 +, resultando en una disminución del ratio CD4 + / CD8 +14 .
Los datos in vitro sugieren que la deficiencia de zinc15.
- Aumenta la monopoyesis.
- Disminuye la actividad de las células asesinas naturales (NK).
- Incrementa la citotoxicidad de los monocitos.
- La quimiotaxis y la fagocitosis y la actividad de neutrófilos también sufre alteraciones dependientes de zinc lo que puede explicar por qué se produce un aumento de la susceptibilidad a las infecciones durante su deficiencia16,17.
- Puede ocasionar un desequilibrio o polarización Th1<Th2 ya que la deficiencia de zinc en humanos disminuye la actividad de la timulina sérica (una hormona tímica) que se requiere para la maduración de células T-CD4. Las citoquinas Th-1 que condicionan la proliferación de CD4+Th1 disminuyen, pero las citoquinas Th-2 no se ven afectadas por la deficiencia de zinc en humanos. Este cambio de la función Th1 a Th2 (dominancia o polarización Th2) da como resultado una disfunción inmune mediada por células ya que la producción de IL-2 (una citoquina Th1 )conduce a una disminución de las actividades de las células T citolíticas y de Natural Killers, que están involucradas en la defensa contra virus, bacterias y células tumorales (Figura 1 ). Esto conduce a una desregulación principalmente en la inmunidad adaptativa que puede resultar en una mayor producción de citoquinas proinflamatorias que den lugar al denominado inflamm-aging.
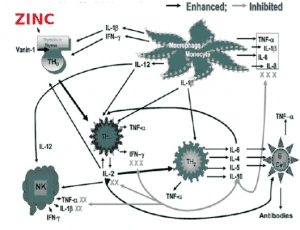

Por otra parte, el zinc es necesario para la inducción de la respuesta inflamatoria mediada por NF-кB, pero una mayor concentración fisiológica del mineral también puede contribuir a la desregulación negativa de la expresión de citoquinas pro-inflamatorias a través de un circuito de retroalimentación negativa que inhibe la activación del NF-кB, de forma que el zinc también demuestra tener efectos antiinflamatorios y antioxidantes in vivo.
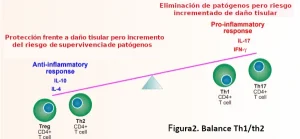
En cualquier caso es esencial que no se produzca dominancia de una vía sobre otra sino equilibrio, siendo crítico el balance entre respuesta pro-inflamatorias y anti-inflamatorias ya que el exceso de la primera conduce a daño e inflamación excesiva, mientras que el desequilibrio de la segunda puede conducir a infecciones crónicas o repetitivas (Figura 2). En este balance el zinc desempeña una función esencial18 .

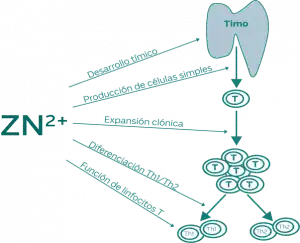

El zinc por tanto es necesario para: (Figura)
- El desarrollo tímico
- La producción de Linfocitos T
- La expansión clonal de linfocitos T
- El balance Th1/Th2
- La función linfocitaria y el mantenimiento de respuesta inmune innata y adaptativa
Características Etiopatológicas de los coronavirus humanos estudiados
Tanto el SARS-CoV como el MERS-CoV y el 2019-nCoV inducen respuestas inmunitarias del huésped no efectivas, excesivas y aberrantes asociadas al desarrollo de una patología pulmonar severa que conduce a la muerte 19-21 . De forma similar que los pacientes con SARS-CoV y MERS-CoV, algunos pacientes con 2019-nCoV desarrollan síndrome agudo de dificultad respiratoria (ARDS). La mayoría de los pacientes que desarrollan enfermedad letal por infección con el 2019-nCoV se codesarrolla junto a la infección la producción del “cytokine storm” o tormenta de citoqinas, caracterizada por un aumento de las concentraciones plasmáticas de interleuquinas 2, 7 y 10, factor estimulante de colonias de granulocitos, proteína quimio atrayente de monocitos, proteína inflamatoria macrófaga 1 alfa y factor de necrosis tumoral α, entre otros 20 . Las personas que superan una infección grave tienen, como consecuencia de estas respuestas inmunitarias aberrantes, daño pulmonar y fibrosis a largo plazo, causante de discapacidad funcional y calidad de vida reducida 22 .
Zinc como antiviral: efecto directo e indirecto


El zinc puede actuar tanto como un antiviral directo, como uno indirecto, estimulando la inmunidad antiviral de forma específica. Durante los últimos 50 años se ha acumulado una gran cantidad de evidencia que sustenta la actividad antiviral del zinc frente a una gran cantidad de virus a través de diversos mecanismos.
El zinc es, además, un componente integral de muchas enzimas virales, incluyendo proteasas y polimerasas, de lo que se deduce la importancia de la regulación de la distribución celular y sistémica de zinc para inhibir la replicación viral y su diseminación23-25.
Efecto directo: El zinc como antiviral
Las propiedades antivirales del zinc parecen ser virus-específicas. En cualquier caso es probable que la disponibilidad de iones de zinc juegue un papel importante en su eficacia antiviral. Son varias las etapas de replicación viral que pueden ser inhibidas por el zinc en distintas familias virales 26 (Figura)
La RNA polimerasa dependiente de ARN del coronavirus del síndrome respiratorio agudo severo (SARS) se inhibe significativamente por acción del zinc 27 (Figura)
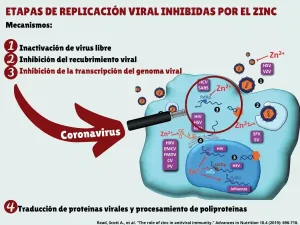

Se ha demostrado que el zinc forma parte de forma extensiva de vías de señalización inmune innatas y adaptativas 28. En el caso de la respuesta inmune antiviral el zinc participa en:
- Señalización de reconocimiento de antígeno29
- Producción de INFs, necesariamente requeridos para el aclaramiento de infecciones virales. Después del reconocimiento de patógenos la activación de NF-κB, induce la expresión de los IFNs. El zinc juega un papel importante en la respuesta a los IFNs mediante la modulación de la secreción, potencia y unión al receptor de estas citoquinas, así como influenciando en la señalización y en los inhibidores de la vía, lo que le convierte en un elemento clave en los procesos de inmunoestimulación e inmunomodulación30.
Conclusión
El papel del zinc como antiviral se puede dividir en 2 categorías:
1) Efecto indirecto de soporte de la respuesta inmune antiviral en pacientes con deficiencia de zinc, tanto por mejora de la señalización como de los mecanismos de activación, maduración y diferenciación del sistema inmune innato y adaptativo.
2) Efecto directo que inhibe específicamente la replicación viral o síntomas relacionados con la infección.
Autor: Ruth Matute, Directora científica de Equisalud.
Biblografía
1. Andreini C, Bertini I. A bioinformatics view of zinc enzymes. J Inorg Biochem 2012;111:150–6.
2. Finamore, A.; Massimi, M.; Conti Devirgiliis, L.; Mengheri, E. Zinc deficiency induces membrane barrierdamage and increases neutrophil transmigration in Caco-2 cells. Nutr. 2008, 138, 1664–1670.
3. Miyoshi, Y.; Tanabe, S.; Suzuki, T. Cellular zinc is required for intestinal epithelial barrier maintenance viathe regulation of claudin-3 and occludin expression. J. Physiol. Gastrointest. Liver Physiol. 2016, 311.
4. Maret, W. Zinc coordination environments in proteins as redox sensors and signal transducers.Antioxid. Redox Signal. 2006, 8, 1419–144110. Bellomo, E.; Hogstrand, C.; Maret,W. Redox and zinc signalling pathways converging on protein tyrosine phosphatases. Free Radic. Biol. Med. 2014, 75 (Suppl. S1), S9.].
5. Truong-Tran, A.Q.; Carter, J.; Ruffin, R.E.; Zalewski, P.D. The role of zinc in caspase activation and apoptotic cell death. Biometals 2001, 14, 315–330.
6. Overbeck, S.; Rink, L.; Haase, H. Modulating the immune response by oral zinc supplementation: A singleapproach for multiple diseases. Immunol. Ther. Exp. Warsz. 2008, 56, 15–30.
7. Gammoh, N.Z.; Rink, L. Zinc in infection and inflammation. Nutrients 2017, 9.
8. World Health Organization (WHO). World Health Organization—The World Health Report; WHO: Geneva,Switzerland, 2002; Volume 83.
9. Rink, L. Zinc in Human Health; IOS Press: Amsterdam, The Netherlands, 2011; p. 596.
10. Wessells KR, Brown KH. Estimating the global prevalence of zinc deficiency: results based on zinc availability in national food suppliesand the prevalence of stunting. PLoS One 2012;7(11):e50568.
11. KumssaDB, JoyEJ, AnderEL,WattsMJ, Young SD,Walker S, BroadleyMR. Dietary calcium and zinc deficiency risks are decreasing but remain prevalent. Sci Rep 2015;5:10974.
12. H. Shankar andA. S. Prasad, “Zinc andimmune function: the biological basis of altered resistance to infection,” The American Journal of Clinical Nutrition, vol. 68, no. 2, pp. 447S–463S, 1998.
13. Sandström, B.; Cederblad, Å.; Lindblad, B.S.; Lönnerdal, B. Acrodermatitis enteropathica, zinc metabolism,copper status, and immune function. Pediatr. Adolesc. Med. 1994, 148, 980–985.
14. Rink, L.; Haase, H. Zinc homeostasis and immunity. Trends Immunol. 2007, 28, 1–4.
15. Gammoh, N.Z.; Rink, L. Zinc in infection and inflammation. Nutrients 2017, 9.
16. Hasan, R.; Rink, L.; Haase, H. Zinc signals in neutrophil granulocytes are required for the formation of neutrophil extracellular traps. Innate Immun. 2013, 19, 253–264.
17. Hasan, R.; Rink, L.; Haase, H. Chelation of free Zn2+ impairs chemotaxis, phagocytosis, oxidative burst,degranulation, and cytokine production by neutrophil granulocytes. Trace Elem. Res. 2016, 171, 79–88.
18. Uciechowski, Peter, et al. “TH1 and TH2 cell polarization increases with aging and is modulated by zinc supplementation.” Experimental gerontology 43.5 (2008): 493-498.
19. Azhar EIHui AThe Middle East respiratory syndrome (MERS).Infect Dis Clin North Am. 2019; 33: 891-905.
20. Huang C Clinical features of patients infected with 2019 coronavirus in Wuhan, China.Lancet. 2020.
21. Severe acute respiratory syndrome: historical, epidemiologic, and clinical features. Infect Dis Clin North Am. 2019; 33: 869-8.
22. Ngai JC The long-term impact of severe acute respiratory syndrome on pulmonary function, exercise capacity and health status. Respirology. 2010
23. Eby GA. Zinc ion availability—the determinant of efficacy in zinc lozenge treatment of common colds. J Antimicrob Chemother1997;40(4):483–93.
24. Fridlender B, Chejanovsky N, Becker Y. Selective inhibition of herpes simplex virus type 1 DNA polymerase by zinc ions. Virology 1978;84(2):551–4.
25. Gupta P, Rapp F. Effect of zinc ions on synthesis of herpes simplex virus type 2-induced polypeptides. Proc Soc Exp Biol Med1976;152(3):455–8.
26. Read, Scott A., et al. “The role of zinc in antiviral immunity.” Advances in Nutrition 10.4 (2019): 696-710.
27. Velthuis AJ, van den Worm SH, Sims AC, Baric RS, Snijder EJ,van Hemert MJ. Zn(2+) inhibits coronavirus and arterivirus RNApolymerase activity in vitro and zinc ionophores block the replication of these viruses in cell culture. PLoS Pathog 2010;6(11):e1001176.
28. Maywald M, Wessels I, Rink L. Zinc signals and immunity. Int J Mol Sci 2017;18(10). doi: ARTN 2222 10.3390/ijms18102222.
29. Brieger A, Rink L, Haase H. Differential regulation of TLR-dependent MyD88 and TRIF signaling pathways by free zinc ions. J Immunol 2013;191(4):1808–17.
30. Brautigan DL, Bornstein P, Gallis B. Phosphotyrosyl-protein phosphatase—specific inhibition by Zn-2+. J Biol Chem 1981;256(13):6519–22.